
期刊:Nature Communications
影响因子:15.7
通讯单位:中科院微生物研究所
通讯作者:孟颂东、李鑫、韦荣国
伯豪技术服务:单细胞转录组测序
导语
当前,面对诸如SARS-CoV-2、流感等高变异率病毒的持续威胁,传统疫苗设计面临两大核心瓶颈:一是所诱导的中和抗体反应往往持续时间短且交叉保护能力有限;二是难以激发强大且持久的T细胞免疫应答,而这对于清除病毒和预防慢性感染(如HPV)至关重要。尽管佐剂(如铝盐、MF59)、纳米颗粒递送系统、mRNA平台等技术不断进步,但如何实现抗原在免疫器官中的长效驻留与精准递送,以同时优化B细胞与T细胞应答,仍是疫苗学领域的圣杯。
热休克蛋白GP96(亦称GRP94)作为内质网中的关键分子伴侣,因其能结合多肽并通过CD91(LRP1)等受体激活树突状细胞(DC),促进抗原交叉呈递,从而在抗肿瘤及抗病毒T细胞免疫中展现出巨大佐剂潜力。然而,其与大分子抗原的结合模式不明,且促进B细胞应答的能力相对较弱,限制了其作为通用疫苗平台的广泛应用。
在此背景下,本研究创新性地提出了一种抗原-GP96 N端融合策略,构建了稳定的二聚体纳米颗粒疫苗。研究不仅证实了该平台能显著增强抗原稳定性与免疫原性,更深入揭示了其通过结合滤泡树突状细胞(FDC)表面的LRP1受体,形成“替代性抗原滞留”的全新机制,从而协同驱动了强大、持久且广谱的体液与细胞免疫。以下,我们将从实验设计与结果解读的角度,层层剖析这项研究的科学内涵。
主要技术
单细胞转录组测序
(技术服务伯豪生物提供)
研究结果
一. 结构引导的理性设计:从“松散结合”到“稳固融合”
1. 设计原理与验证:
研究首先利用AlphaFold3对包括SARS-CoV-2 RBD、流感HA1、HPV L1在内的多种病毒抗原与GP96的结合模式进行了大规模计算模拟筛查(图1A)。结果显示,这些抗原主要倾向于结合GP96的N端结构域(NTD)。因此,团队决定将抗原融合于GP96的N端,以最大限度地减少空间位阻,确保抗原表位(如RBD的受体结合基序RBM)完全暴露(图1B, C)。
与仅能结合短肽的天然GP96不同(Supplementary Fig. 2C),这种融合策略利用GP96自身C端的二聚化特性以及RBD的相互作用,形成了在N端和C端均更加紧密的二聚体结构(RBD-GP96-Fusion)。分子动力学模拟证实,融合后的二聚体构象波动(RMSD)更小,稳定性更高(图1D, E)。实验表征显示,纯化的融合蛋白分子量约为231 kDa,符合二聚体预期(图1F, G)。透射电镜直观展示了RBD-GP96-Fusion形成了更为紧凑的纳米颗粒(~10-14 nm),而单独的GP96结构则相对松散(图1H)。质谱分析进一步揭示了在部分融合蛋白中,两个RBD之间可形成二硫键,呈现出N端“闭合”与“开放”两种构象(图1I),这与结构预测相符。

图1. 抗原-GP96融合策略的结构引导性设计和关键结构的特性:以RBD-GP96融合为例
2. 功能与稳定性评估:
关键的是,融合设计并未损害抗原本身的生物学功能。表面等离子共振和ELISA实验表明,RBD-GP96-Fusion与宿主受体hACE2的结合亲和力与天然的RBD二聚体相当,证明RBM表位被完整保留并充分暴露(图2A, B)。更重要的是,融合显著提升了抗原的物理稳定性和抗酶解能力。纳米差示扫描荧光法显示,融合蛋白的热聚集温度显著高于单独的RBD(图2C);胰蛋白酶保护实验证明,GP96的存在使融合蛋白在酸性环境下更能抵抗酶切降解(图2D)。这种增强的稳定性直接转化为了优异的体内滞留性:活体成像显示,皮下注射后,RBD-GP96-Fusion在注射部位和引流淋巴结中的荧光信号滞留时间远超单独的RBD或GP96,表现出明显的“抗原库”效应(图2E)。
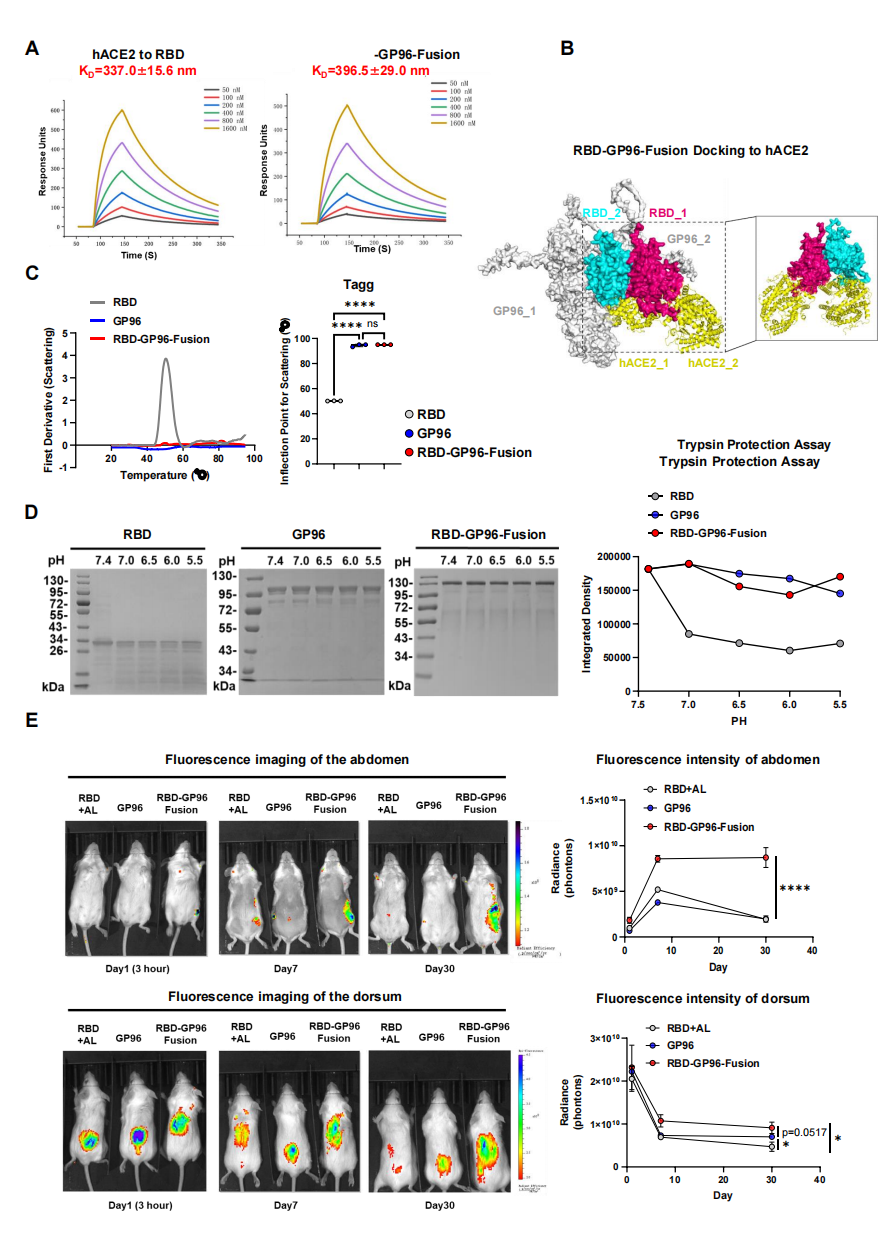
图2. RBD-GP9-Fusion疫苗的生物稳定性和免疫迁移
二、 卓越的免疫原性:驱动强大而持久的体液免疫
1. 高效且持久的抗体应答:
在BALB/c小鼠模型中,与铝佐剂或GP96简单混合的RBD相比,RBD-GP96-Fusion疫苗诱导产生了显著更高滴度的抗原特异性IgG、IgG1、IgG2a/b及IgM抗体,且该高水平抗体可维持至少6个月(图3B)。更重要的是,它诱导的抗体具有出色的交叉反应性,对多种SARS-CoV-2变异株(Alpha, Beta, Omicron等)的S1或RBD蛋白均能产生强效结合(图3C, D)。这些抗体不仅结合力强,功能上也更优越:血清表现出更强的抗体依赖性细胞介导的细胞毒性(ADCC)报告活性(图3E)以及针对原型株和Omicron BA.1活病毒的高滴度中和能力(图3F)。将此策略应用于XBB.1.5毒株RBD,同样诱导出强大的交叉中和抗体(图3G)。
2. 长效保护与记忆形成:
在hACE2转基因小鼠攻毒实验中,RBD-GP96-Fusion免疫组展现出显著的保护效力:肺部病毒载量更低,且病理切片未见严重肺炎(图3H-J)。免疫后6个月,仅在融合疫苗组小鼠的骨髓中检测到了大量的RBD特异性长寿命浆细胞(LLPC)(图3K, L),这是长期体液免疫保护的基石。值得注意的是,该疫苗几乎不引发针对GP96自身的抗体反应(Supplementary Fig. 8D),降低了自身免疫风险。
三. 核心机制:单细胞分辨率下的“替代性抗原滞留”与免疫细胞互作图谱
为了在单细胞精度上解析融合疫苗的作用机制,研究团队对免疫后引流淋巴结中捕获了荧光标记抗原的细胞进行了单细胞RNA测序分析。
1. 构建抗原结合细胞的单细胞图谱:
通过流式分选Cy5+的细胞进行scRNA-seq,数据经过质控和聚类后,初步得到了包括B细胞、T细胞、单核/巨噬细胞等在内的8个主要细胞大类(Supplementary Fig. 9D, E),为后续精细分析提供了框架。这一方法直接捕捉了与抗原相互作用的细胞群体,避免了背景噪音。
2. 揭示B细胞亚群的偏好性结合:
对B细胞进行亚群重聚类,根据经典标记物鉴定出5个亚群:边缘区B细胞、初始B细胞、CD69+ B细胞、生发中心B细胞和前GCB细胞(Supplementary Fig. 10A, B)。分析显示,RBD-GP96-Fusion蛋白与生发中心B细胞的结合最为显著(图3M, N)。差异表达基因的功能模块富集分析进一步表明,在融合疫苗组中,GC B细胞上调的基因模块主要集中于氨基酸代谢以及与抗原呈递细胞形成免疫突触相关的通路(Supplementary Fig. 10C, D)。这从转录组层面提示,融合抗原可能为GC B细胞提供了更强的活化与代谢重编程信号。
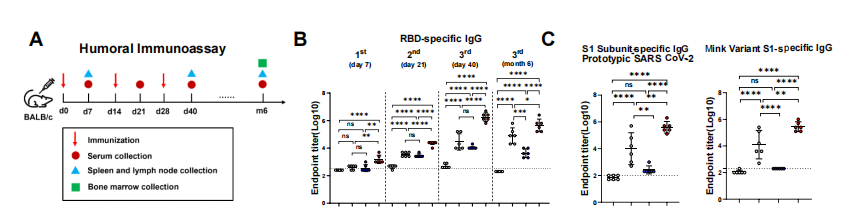
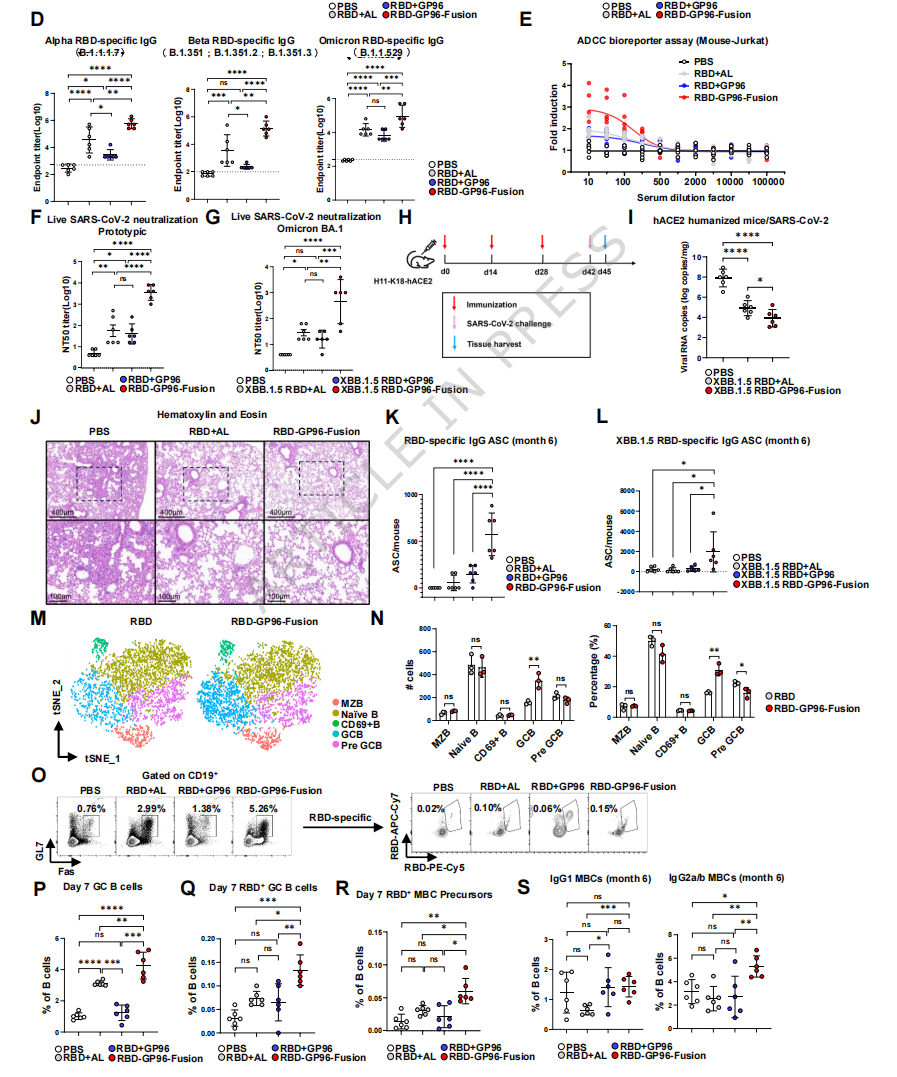
图3. RBD-GP96-Fusion疫苗诱导IgG滴度鲁棒性与GC B细胞强烈的抗原特异性响应
3. 发现抗原在FDC上的关键锚定细胞群:
对单核/巨噬细胞进行亚群分析,鉴定出6个亚群(Supplementary Fig. 15A, B)。其中,滤泡树突状细胞是RBD-GP96-Fusion结合增加最显著的群体(图4A, B)。该群细胞的差异表达基因富集在“细胞因子介导的信号通路”和“细胞间黏附的调节”等功能模块(Supplementary Fig. 15C),暗示融合蛋白可能促进了FDC与靶细胞(如B细胞)间的直接或间接相互作用。单细胞测序数据为后续聚焦于FDC的机制研究提供了关键的细胞靶点指引。

图4. RBD-GP96-Fusion疫苗通过GP96和FDC,在GC B细胞中产生抗原滞留的替代性机制
4. 解析T细胞应答格局:
同样,对T细胞亚群的分析揭示了7个主要亚群(Supplementary Fig. 23A, B)。与对照组相比,RBD-GP96-Fusion显著增加了与CD8+ 效应T细胞的结合(图5A, B)。这些CD8+ 效应T细胞的差异表达基因在“白细胞介导的细胞毒性”、“杀伤调节”等通路上富集(Supplementary Fig. 23C, D)。此外,利用CellPhoneDB进行的细胞间相互作用分析预测,在融合疫苗组中,CD8+ 效应T细胞与经典树突状细胞之间的通讯信号增强(图5C)。这些单细胞层面的发现,完美衔接并解释了后续观察到的强大细胞免疫表型。
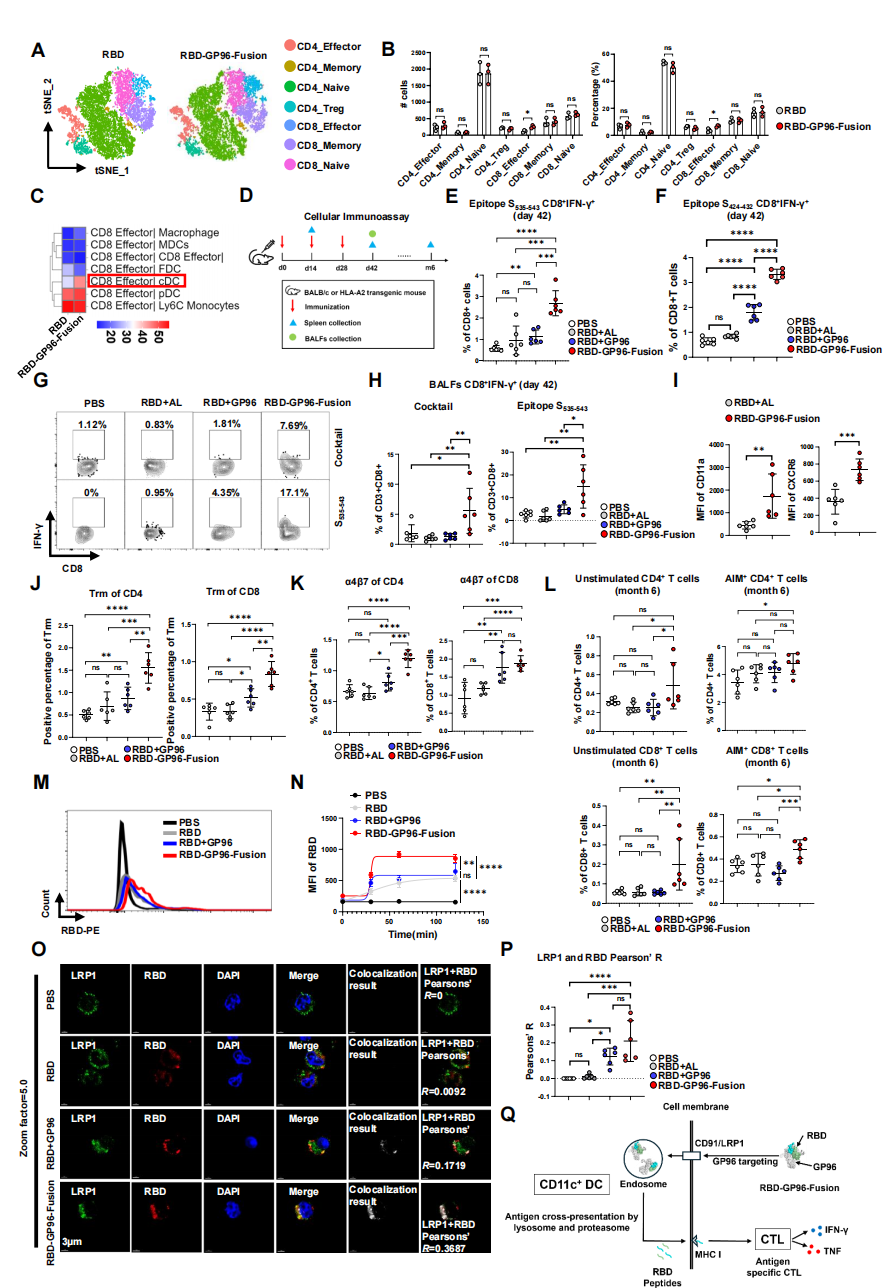
图5. RBD-GP96-Fusion疫苗通过增强DC细胞靶向能力,诱导广泛而长效的T细胞响应
四. 机制深化:“替代性抗原滞留”驱动生发中心B细胞反应
基于单细胞测序发现的线索,研究进一步在细胞和分子层面深入探索。
1. 靶向生发中心B细胞与FDC:
流式细胞术验证了scRNA-seq的发现。免疫后第7天,融合疫苗组小鼠淋巴结中GC B细胞及其抗原特异性亚群的比例和数量均显著高于对照组(图3O-Q)。同时,也诱导产生了更多的抗原特异性记忆B细胞前体(图3R)。这些GC反应的强度与最终的抗体滴度及中和效价高度相关(Supplementary Fig. 13)。
2. 突破经典途径:LRP1介导的抗原锚定
FDC是GC中储存和呈递完整抗原给B细胞的“图书馆”。传统上,FDC通过其表面的Fc受体或补体受体捕获抗原-抗体复合物。本研究发现了一条全新的抗原递呈途径:即使阻断FcR,RBD-GP96-Fusion在FDC上的富集仍显著高于RBD对照组(图4C)。机制探究表明,GP96能直接结合FDC表面高表达的LRP1受体。当同时阻断FcR和LRP1时,融合抗原与FDC的结合几乎被完全抑制(图4E-G)。体内外实验均证实了RBD-GP96-Fusion通过GP96-LRP1相互作用锚定在FDC表面(图4J, K),并且这种结合能直接桥接FDC与B细胞(图4L)。
3. 功能验证:延长B细胞-FDC互作
延时活细胞成像技术直接观察到,经RBD-GP96-Fusion预处理的FDC,与GC B细胞的相互作用时间显著延长,而这一效应可被LRP1抗体特异性阻断(图4M-O)。这为“抗原滞留”提供了直观的功能证据。结构模型也显示,在RBD-GP96-Fusion与LRP1/CD91-α的对接中,RBM表位依然保持暴露(图4Q)。研究人员进一步通过分子动力学模拟和点突变实验,精细解析并验证了GP96与CD91-α的关键结合界面(Supplementary Fig. 21, 22)。
综上所述,该研究揭示了一个清晰的机制通路(图4R):RBD-GP96-Fusion凭借GP96增强的稳定性,更有效地进入淋巴滤泡,其GP96部分通过结合FDC表面的LRP1,绕过或协同经典FcR/CR途径,将大量完整抗原长期“锚定”在FDC表面。这种“替代性抗原滞留”为GC B细胞提供了持续、高浓度的抗原刺激信号,从而驱动了高强度、高亲和力的抗体成熟与长效记忆B/浆细胞的形成。
五、 强大的交叉性与组织驻留T细胞免疫
1. 系统性T细胞应答:
融合疫苗同样极大地提升了细胞免疫水平。在脾脏中,它诱导了更高水平的Th1型细胞因子分泌和针对保守表位(如S535-543)的特异性CD8+ T细胞应答(图5E, F)。这种应答在免疫早期即可建立(Supplementary Fig. 25),并能维持长达6个月,其间干细胞样记忆T细胞比例显著升高(Supplementary Fig. 28)。
2. 肺部黏膜免疫与组织驻留记忆:
尤为引人注目的是,RBD-GP96-Fusion疫苗在肺部诱导了强大的黏膜相关T细胞免疫。支气管肺泡灌洗液中,抗原特异性CD8+ IFN-γ+ T细胞比例急剧上升(图5G, H),且这些细胞高表达归巢受体CD11a和肺部驻留相关的CXCR6(图5I)。在肺组织内,疫苗显著增加了CD69+CD103+的组织驻留记忆T细胞以及表达α4β7整合素的T细胞比例(图5J, K)。这表明该疫苗能驱动效应T细胞向呼吸道黏膜迁移并定居,形成局部免疫防线。
3. 抗原递呈机制:
在分子机制上,融合疫苗通过GP96-LRP1相互作用,被DC更快速、更大量地内吞(图5M-P)。进入细胞后,抗原经由溶酶体/蛋白酶体途径被加工,肽段被递送至内质网,从而高效地通过MHC I类途径进行交叉呈递,激活CD8+ T细胞(图5Q)。
六、 平台普适性验证:应用于HPV疫苗设计
为了证明该策略的通用性,研究团队将其应用于人乳头瘤病毒疫苗设计,构建了HPV-18 L1-GP96-Fusion 和 E7-GP96-Fusion。
1. L1疫苗:L1-GP96-Fusion在诱导中和抗体滴度上与经典佐剂(AS04, MF59)相当或更优,且显著增强了Th1型的IgG2a反应和GC B细胞应答(图6E-I)。更重要的是,它诱导的CD8+ T细胞应答更强,在体外能更有效地杀伤HPV感染的细胞系,且杀伤效力与CD8+ IFN-γ+ T细胞频率正相关(图6J-O)。
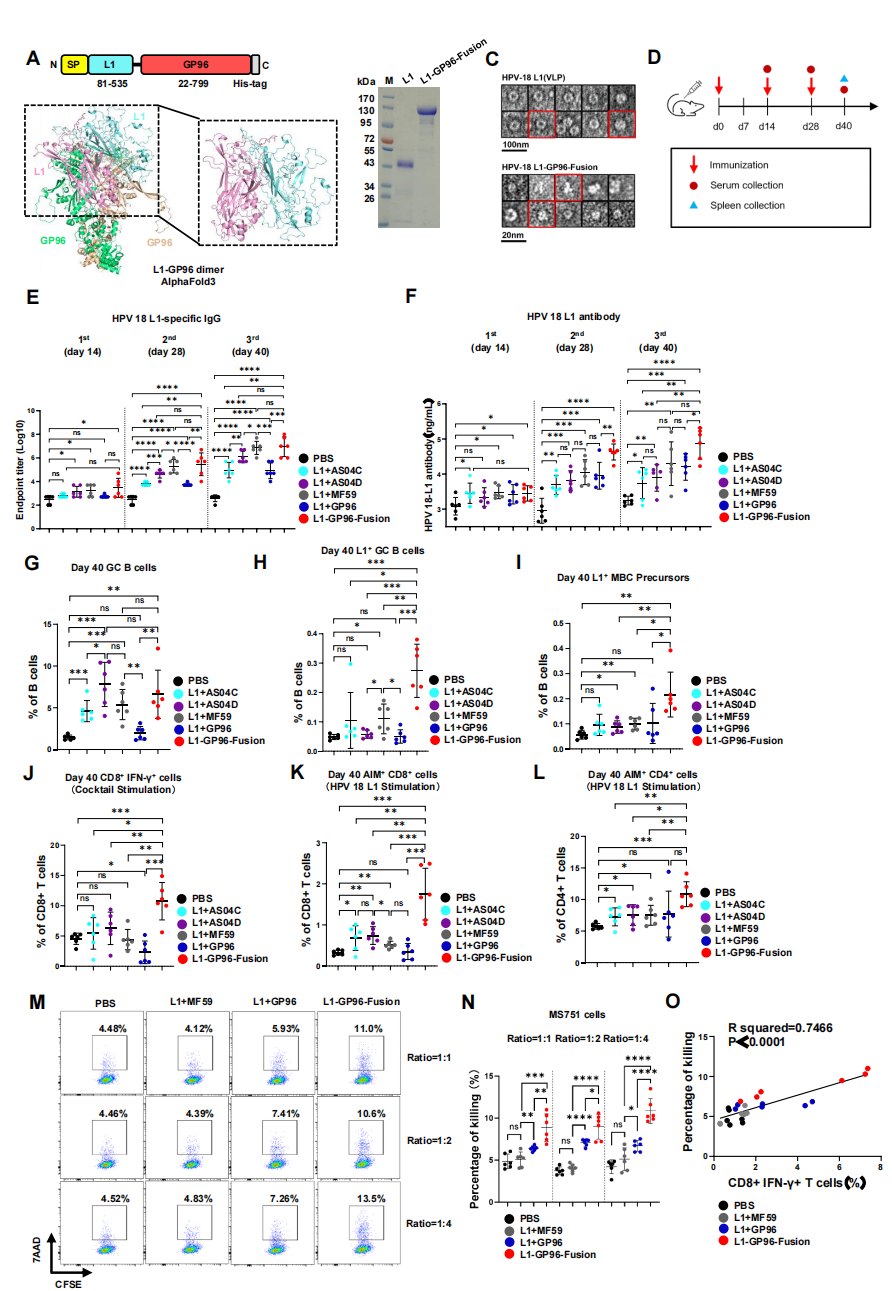
图6. 融合策略HPV疫苗L1-GP96-Fusion的设计与评估
2. 治疗性E7疫苗:E7-GP96-Fusion则展现了卓越的治疗性潜能。它诱导了极高水平的CD8+ T细胞产生IFN-γ、颗粒酶B和穿孔素(图7A-D)。在宫颈癌HeLa细胞移植瘤模型中,过继输注经E7-GP96-Fusion免疫小鼠的CD8+ T细胞,能显著抑制肿瘤生长、减小瘤重,并导致肿瘤内CD8+ T细胞浸润大幅增加(图7E-J),展现了强大的抗肿瘤效果。
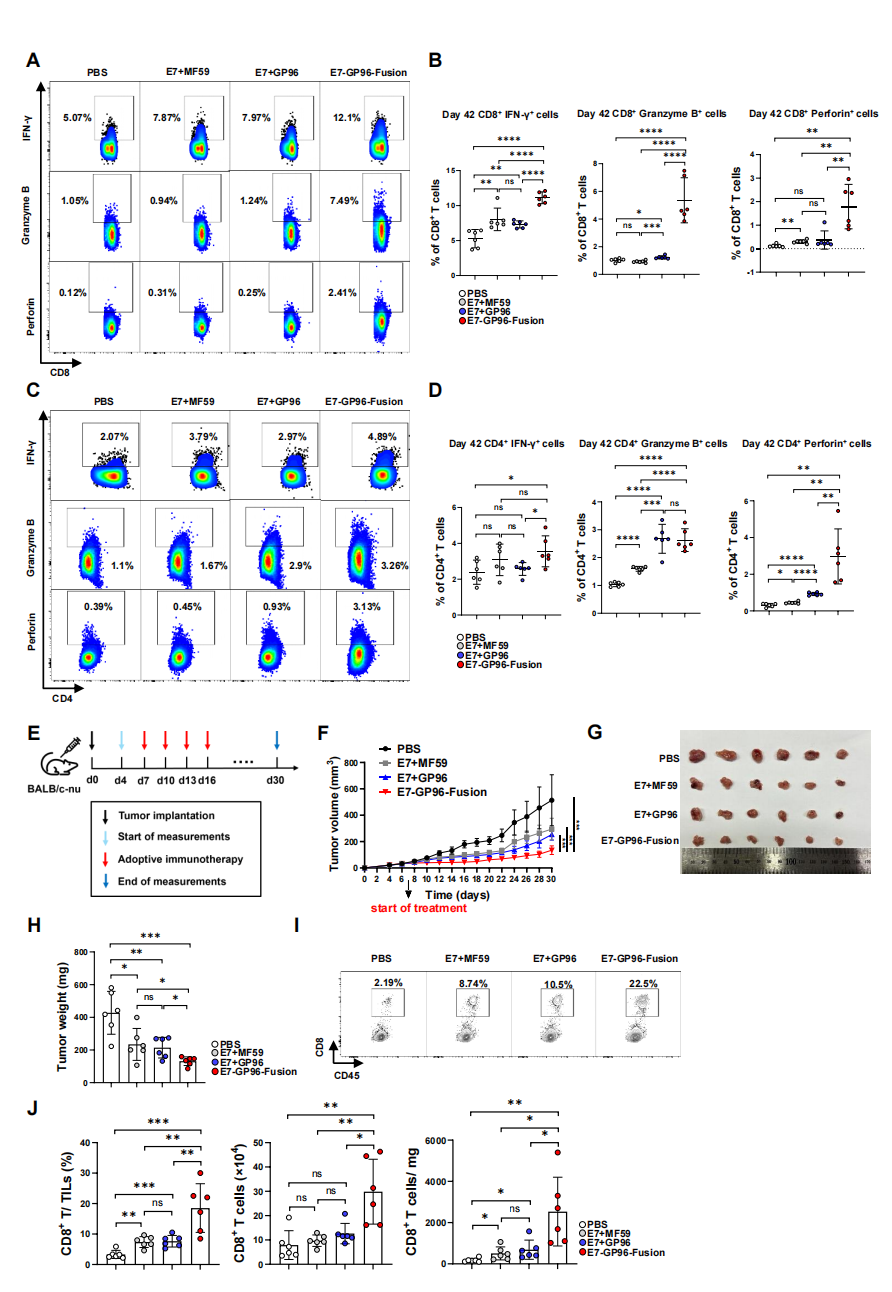
图7. 融合策略HPV阳性肿瘤疫苗E7-GP96-Fusion的设计与清除效应评估
讨论与展望
本研究通过结构引导性的设计,将抗原与GP96的N端融合,创造了一个集抗原稳定性增强、靶向性递送、长效滞留与交叉呈递促进于一体的多功能疫苗平台。其核心科学贡献在于发现了通过GP96-LRP1轴在FDC实现“替代性抗原滞留”的新机制,这为理解如何延长抗原暴露、优化GC反应提供了全新视角。单细胞测序技术的运用,不仅无偏地验证了融合抗原对关键靶细胞(GC B细胞、FDC、CD8+效应T细胞)的特异性结合,还从转录组层面揭示了这些细胞的功能状态变化,为整个机制链条提供了高分辨率的细胞学证据。
与现有佐剂相比,该平台具有多重优势:
* 机制明确:直接靶向LRP1,而非非特异性刺激。
* 效力强大:在诱导抗体广度、滴度、持久性及T细胞应答(尤其是细胞毒性CD8+ T细胞和组织驻留记忆)上,均优于铝佐剂、MF59等。
* 安全性好:炎症反应温和,不易引发抗GP96自身抗体。
* 生产可行:蛋白结构相对简单,易于规模化生产。
当然,研究也指出了未来方向:如探索鼻内等黏膜接种途径以激发更强的黏膜IgA应答;利用结构生物学手段精确解析抗原-GP96复合物晶体结构;将该平台拓展至流感、肠道病毒等其他难缠病原体。
总而言之,这项研究不仅报道了一种高效的新型疫苗设计策略,更通过深入细致的机制探索,为下一代旨在同时提供长效体液免疫和强大组织驻留T细胞免疫的疫苗研发,树立了一个重要的范例。其揭示的“替代性抗原滞留”原理,有望广泛应用于抗感染、抗肿瘤等多个免疫治疗领域。
参考文献:
1. Wang J, Yu W, Shen H, et al (2025) Therapeutic Black Phosphorus Nanosheets Elicit Neutrophil Response for Enhanced Tumor Suppression. Adv Sci (Weinh) 12:e2414779. https://doi.org/10.1002/advs.202414779
