这篇文章必须收藏——溶瘤腺病毒最全改造方案!
溶瘤病毒,是指能特异性感染肿瘤细胞并在肿瘤细胞中大量复制,最终裂解肿瘤细胞,并释放出在肿瘤间自行扩散的病毒,最终消灭全部肿瘤的一类病毒。
溶瘤病毒治疗与基因治疗不同,它不必发现肿瘤相关抗原,只需保证病毒在肿瘤细胞内特异性增殖就可起到杀伤肿瘤细胞的作用。
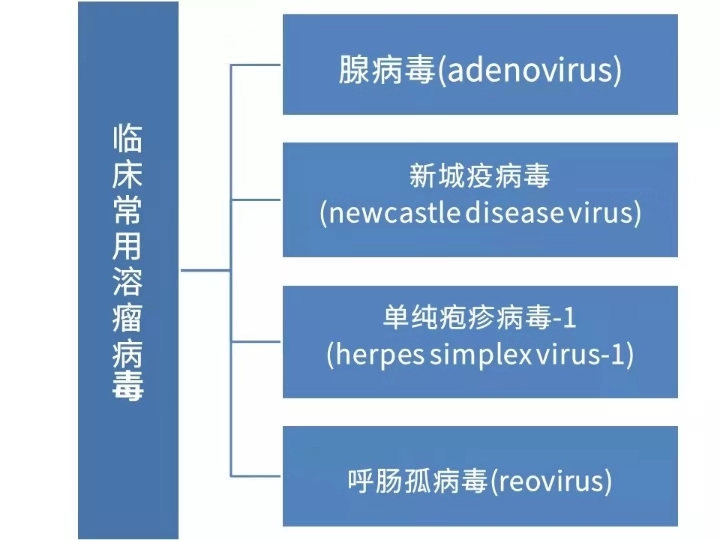
溶瘤病毒种类
Ad5型溶瘤腺病毒(oncolytic adenovirus,OAd)以基因组简单,研究较深入而获得广泛应用,我国OAd/所有溶瘤病毒在研占比为40.5%。Ad5基因组为线形双链DNA,大小约为36 kb,分为早期(ElA、ElB、E2、E3、E4、Ⅸ和Ⅳa2)和后期(Ll~L5)转录单元。
腺病毒基因组
OAd作为治疗肿瘤的新型技术,其优化设计主要围绕溶瘤性、安全性思路进行,针对病毒基因组进行工程化改造: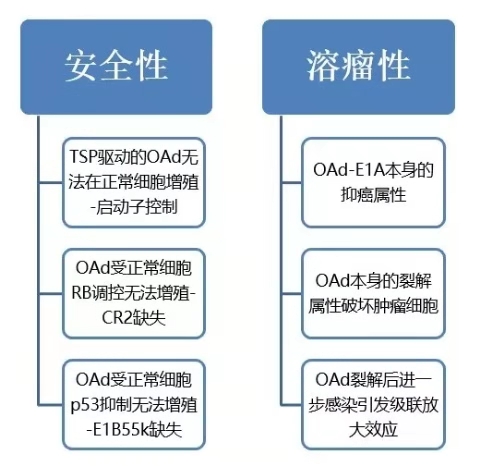
OAd特性
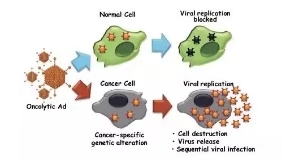
OAd特异性杀伤示意图
OAd改造原理如下:
一 、E1A改造1. E1A-CR2缺失
E1A是最早被转录的片段,是起始病毒复制的关键分子,具有抑制某些癌基因和激活某些抑癌基因, 降低癌细胞在体内的致瘤性及抗转移等活性。
E1A蛋白包含三个保守区域CR1、CR2、CR3,E1A-CR2区可结合视网膜细胞瘤突变基因(RB1-抑癌基因,在众多的癌肿里处于突变状态,因于眼部恶性肿瘤发现而得名),促使细胞复制进入S 期,为病毒复制提供条件。
肿瘤普遍存在RB调控缺陷,因此,删除CR2不影响OAd在肿瘤细胞的复制,而正常细胞由于RB的调控遏止了E1A驱动的细胞周期调控,达到特异性的在肿瘤细胞内复制的效果[1]。
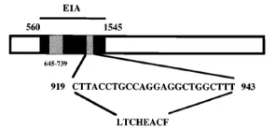
E1A-CR2缺失
2. E1A-特异性启动子调控
病毒于肿瘤细胞的选择性复制是通过特异性的肿瘤组织启动子,来控制病毒增殖必需基因的表达而获得。将肿瘤组织特异性启动子(TSP)取代E1A基因自身的启动子,使其只能在肿瘤细胞内表达,而在正常细胞内处于低表达或者不表达状[2]。
TSP包含两类:
1. 广谱性肿瘤特异性的启动子:这类启动子在所有的肿瘤细胞中表达,如survivin 启动子、环氧化酶(COX-2) 启动子、hTERT 启动子;
以hTERT为例说明:端粒酶在大多数恶性肿瘤细胞中处于激活状态而在正常细胞中没有活性或活性很低,是目前所报道最为广谱的肿瘤生物分子标记。利用端粒酶逆转录酶启动子来调控病毒复制增殖所必需的基因,理论上可使病毒选择性在端粒酶阳性的肿瘤细胞中增殖。
2. 针对特定肿瘤的启动子:此类启动子只在特定肿瘤细胞表达,如:
前列腺特异性抗原(PSA)启动子、甲胎蛋白(AFP)肝癌启动子、癌胚抗原(CEA)上皮癌启动子。
二、E1B改造
E1B包含E1B-19K、E1B-55K两个蛋白,与细胞周期调控相关:
1. E1B-55 K
腺病毒在细胞内复制会激活TP53介导的凋亡通路,而E1B-55K可结合TP53,使之失活,从而抑制被感染细胞的凋亡。缺失了E1B-55K的腺病毒将不能在TP53功能正常的细胞内有效复制,而在TP53基因突变、缺失或功能失活的细胞内却能大量复制并裂解杀伤细胞(大部分肿瘤的发生伴随TP53抑癌基因的功能缺失)[1]。
2. E1B-19K
E1B-19K所编码产物功能与抗凋亡因子BCL-2类似,抑制被感染细胞死亡,允许病毒复制。19K的缺失能够通过多途径诱导肿瘤细胞凋亡,增强病毒传播能力[3]。早期OAd病毒以缺失55k为主,而同时删除19k+55k不仅可以增加病毒靶向性,还能提高病毒的促凋亡能力。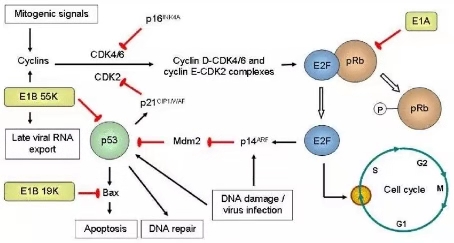
E1B蛋白机制
三、E3改造
E3编码抑制抗病毒免疫应答的蛋白,参与病毒宿主相互作用,可减弱被感染细胞被机体免疫识别的概率。E3区含有多个蛋白E3-12.5K,6.7K,gp19k,ADP,RID等,且改造出现以下几种分歧:
保留E3
E3的存在赋予了早期细胞破坏和后代释放的优势,这是体内有效溶瘤效应所必需的,而E3区域的缺失导致病毒基因表达下降,复制减弱,病毒清除加速和抗肿瘤效果降低。
删除gp19k
gp19 kDa蛋白抑制MHC I类分子的表达,避免感染细胞被效应T细胞识别,该段缺失表现为病毒复制以及抗肿瘤效果增加。
删除E3B
E3B保护感染细胞免于因TNF,TRAIL,FasL介导的凋亡作用,删除可促进凋亡,引发急性炎症作用。
删除ADP
ADP即死亡蛋白,可促进细胞溶解,介导病毒释放。删除该蛋白可减缓病毒释放进程,从而增加病毒在细胞中的复制数量。
E3改造策略
E3区域的个性化改造表明:针对不同的肿瘤,E3区域的改造显示出差异性的溶瘤效果。目前,绝大多数进入临床实验的为E3B缺失。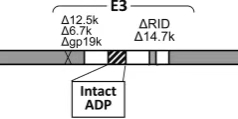
E3结构示意图
四、联合应用
前三点为基础的OAd改造策略,OAd还可作为载体构建外源免疫相关基因,或者联合传统放化疗、生物疗法如CAR-T、单抗等,通过多种途径协同作用杀伤肿瘤细胞。所涉及的改造技术点总结如下:
OAd共表达免疫刺激基因
包括细胞因子IL-12、IFN-γ、GM-CSF,趋化因子CCL5和HSP等:募集免疫效应细胞,增强抗肿瘤免疫应答[4][5]
OAd共表达siRNA
将原癌基因或者免疫抑制基因进行敲减,增强抗肿瘤作用。如PD1、K-RAS等[6]
OAd联合杀伤
OAd联合CAR-T、单抗、化疗、放疗等其他治疗手段,协同抗肿瘤,达到更好的治疗效果[7]
修饰OAd外壳蛋白(Fiber)
Fiber改造的病毒可提升病毒感染效率或靶向特定器官,提升治疗效果。如RGD修饰的Fiber可解决肿瘤低表达柯萨奇受体引发的感染低效的问题[8]
采用修饰或者非人源外壳包装OAd
逃避中和抗体,减弱免疫对腺病毒的灭活效应[9]
OAd与CAR-T类似,个性化程度较高,针对不同的肿瘤,联合不同的手段呈现的结果也不尽相同。以上的五点策略均可从前人的研究中获得直接的数据,若数据或者结果不理想,可参考M1溶瘤病毒的研究方法,将溶瘤病毒与400余种小分子抗肿瘤化合物联合使用筛选,获得最佳组合方式。
OAd作为新型的治疗手段,也有不足点:
1. OAd对肿瘤的特异性杀伤能力还有待提高,在肿瘤发生的早期,肿瘤细胞与正常细胞异质性较小,导致OAd复制及杀伤能力较弱。
2. OAd目前限于肿瘤原位注射,无法根除转移瘤。合理、高效的给药方式有待进一步开发。
3. 人体本身对病毒的排斥反应降低了溶瘤效果;病毒高效的靶向性有待进一步提升,这些都需要对病毒本身进行系统的研究开发。
尽管OAd在治疗肿瘤中还存在不足,但临床研究证实,腺病毒治疗肿瘤的安全性和前瞻性毋庸置疑(相比逆转录病毒随机插入的的致癌风险)。未来十年将是我国创新药高速发展的阶段,目前已有超200种在研的溶瘤病毒,其中近10个自主研发的溶瘤病毒产品进入临床研究阶段,相信溶瘤病毒、CAR-T、TCR-T这些新兴的生物疗法会大放异彩,为更多的肿瘤患者带来福音。
吉凯基因依托PXC1野生型溶瘤腺病毒骨架,可进行不同类型的OAd改造,欢迎前来咨询!!!

野生型PXC1溶瘤病毒穿梭载体
【参考文献】
1.Oncolytic adenoviral mutants induce a novel mode of programmed cell death in ovarian cancer
2.Oncolytic viruses driven by tumor-specific promoters
3.Oncolytic Adenoviral Mutants with E1B19K Gene Deletions Enhance Gemcitabine-induced Apoptosis in Pancreatic Carcinoma Cells and Anti-Tumor Efficacy In vivo
4.A novel combination treatment of armed oncolytic adenovirus expressing IL-12 and GM-CSF with radiotherapy in murine hepatocarcinoma
5.Targeting the intratumoral dendritic cells by the oncolytic adenoviral vaccine expressing RANTES elicits potent antitumor immunity
6.Antitumor activity of an oncolytic adenovirus-delivered oncogene small interfering RNA
7.Improving CART-Cell Therapy of Solid Tumors with Oncolytic Virus–Driven Production of a Bispecific T-cell Engager
8.Enhanced Transduction and Replication of RGD-Fiber Modified Adenovirus in Primary T Cells
9.Oncolytic adenovirus based on serotype 3
如想关注最新科研进展,请关注我们↓↓↓↓
