
研究背景
肺纤维化(Pulmonary fibrosis,PF)是一种严重的呼吸道疾病,能导致肺功能进行性丧失。PF的平均生存期仅有2-4年,已经成为全球范围内主要的难治性疾病之一。目前,PF的临床治疗手段主要是药物干预,氧疗、肺移植等。这些治疗手段虽然能够在一定程度上缓解肺纤维化的症状,却不能阻止肺纤维化的进程。因此,当前临床亟需针对PF的有效治疗手段。
近年来的多项研究指出,肺纤维化和线粒体受损密切相关。在外界刺激下,肺部的上皮细胞、成纤维细胞、免疫细胞等的线粒体受到损伤,导致线粒体功能紊乱,从而激活下游纤维化通路。为此,针对PF的发病机制,以受损线粒体为治疗靶点,进行线粒体补充治疗有望阻止PF的进程。
其中,线粒体补充治疗可分为直接的线粒体移植,和间接的细胞间线粒体转移。对于直接的线粒体移植来说,其疗效虽得到广泛的确证,却存在不少应用限制,例如提取步骤繁琐、易失活、细胞摄取效率低、缺乏靶向性等。而另一方面,利用细胞自发的线粒体转移能力,将天然细胞作为线粒体载体,可以避免线粒体移植的缺陷,例如其无提取步骤、可以保障线粒体活力,具备单向转移能力。其中,间充质干细胞(Mesenchymal stem cell,MSC)由于来源丰富、低免疫原性、炎症趋向性、低氧化损伤水平、低能量需求而常被用作线粒体的靶向递送载体。然而,MSC固有的线粒体转移效率较低,这限制了线粒体治疗的疗效。
研究思路
浙江大学药学院高建青教授/张添源研究员团队前期利用氧化铁纳米粒改良的间充质干细胞构建了第一代“干细胞超级电池”(V1.0),实现了向受损肺细胞的靶向线粒体补充治疗(Science Advances. 2021,7(40):eabj0534,当期特别推荐文章)。然而,第一代改良技术无法实现对受损部位的持续、高效线粒体输送,因而在已经进展的肺纤维化小鼠上的疗效有限。为解决这一难题,团队进一步开发了第二代“干细胞超级电池”(V2.0,Pg-Fe-hMSC),联合使用吡格列酮和氧化铁纳米粒,以同时提高MSC的线粒体数量和递送效率,从而实现靶向受损肺细胞的持续、高效线粒体“再充电”。Pg-Fe-hMSC在已经进展的严重肺纤维化小鼠模型上展现了良好的疗效(图1)。
该论文在近期被Nature Communications(IF=16.6)推荐为编辑精选论文(Editors’ Highlights)。Nature Communications Editors’ Highlights为Nature Communications编辑部精选的近期发表的50篇最优论文。
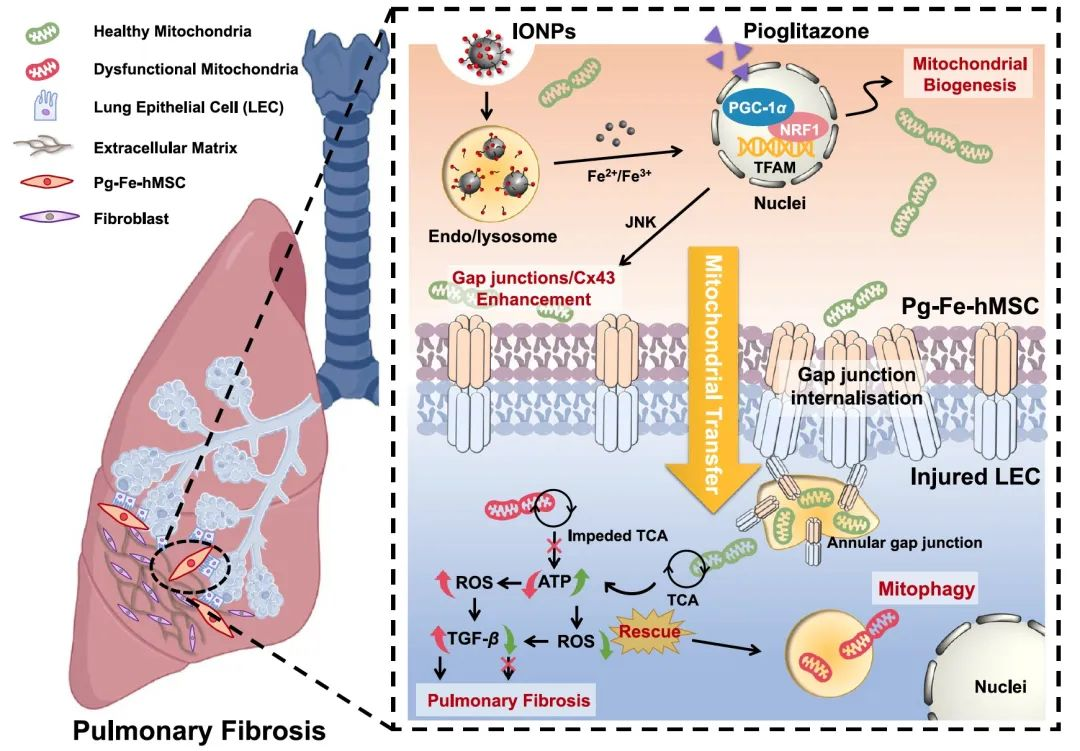
图1.通过构建第二代“干细胞超级电池”(V2.0,Pg-Fe-hMSC),有效干预肺纤维化的进展。
研究结果
首先,研究者设置系列的吡格列酮处理浓度及时间,以筛选出针对人胎盘来源MSC(hMSC)最佳的处理条件。在最佳处理条件下,吡格列酮能够有效地提高hMSC胞内的线粒体含量。通过荧光共聚焦图像、流式细胞术、PCR结果发现,提高hMSC胞内的线粒体含量可以在一定程度上促进细胞间的线粒体转移,且这一过程与PGC-1α相关(图2)。
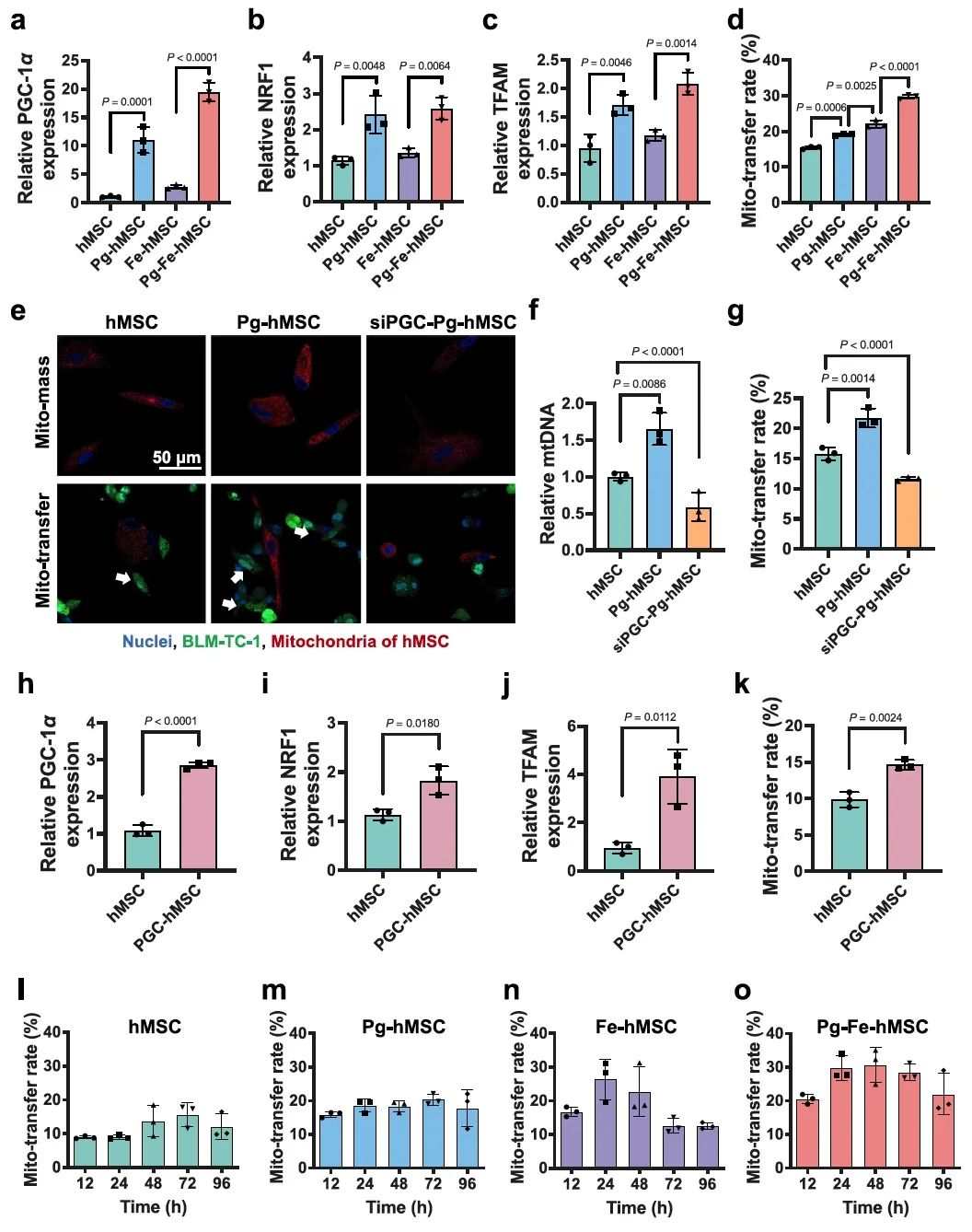
图2.吡格列酮提高hMSC的线粒体含量,促进线粒体的高效和持续递送。
进一步地,研究者们比较不同处理的hMSC对受损肺细胞的保护作用。通过比较各组细胞的胞内ATP水平、ROS含量、线粒体膜电位、细胞活力,可以发现,Pg-Fe-hMSC表现出了更好的保护作用。随后,分别使用PGC-1α-siRNA和PGC-1α质粒转染hMSC,以下调或上调hMSC的PGC-1α表达水平。结果发现,PGC-1α的下调降低了hMSC的保护作用,而PGC-1α的上调提高了hMSC的保护作用。这一结果表明,持续高效的线粒体递送能力有助于有效恢复严重受损的肺上皮细胞的线粒体功能(ATP水平),降低胞内的过量ROS,进而有效拯救受损的肺上皮细胞(图3)。
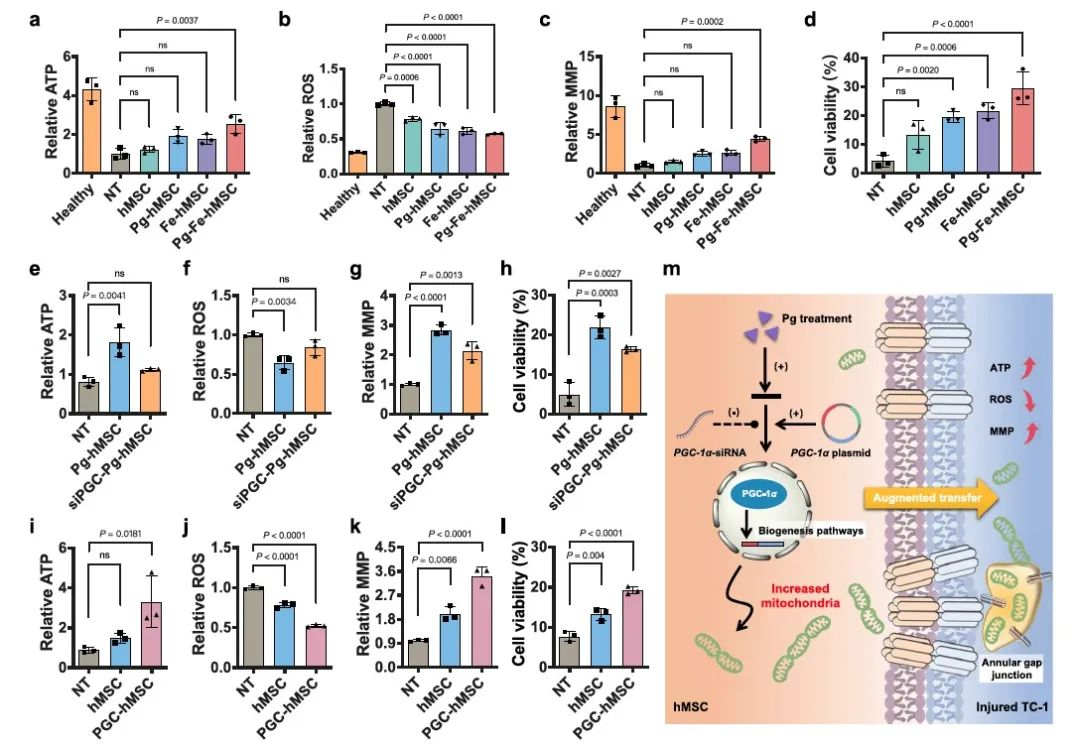
图3.Pg-Fe-hMSC的持续高效线粒体递送,有助于受损肺上皮细胞的线粒体功能恢复。
基于前述研究结果,继续考察Pg-Fe-hMSC对处于疾病进展期PF小鼠的治疗作用。分别在BLM诱导肺损伤后的第7、10天尾静脉注射给予PF小鼠相同剂量的hMSC、Pg-hMSC、Fe-hMSC、Pg-Fe-hMSC。在BLM注射后的第28天,未接受任何治疗的PF小鼠生存率降至60%左右,而各组hMSC的干预治疗能够使其生存率上升至70%以上。采用micro-CT观察治疗终点下各组小鼠的肺部病变情况,结果显示,未治疗的PF小鼠肺部有大量不均匀的斑片状阴影,肺边缘模糊。天然hMSC的治疗无法有效减少PF小鼠肺部的纤维化病灶面积,而其他三组hMSC可以在一定程度上减轻其纤维病变程度,且Pg-Fe-hMSC的减轻程度最为显著。肺病理切片肺病理切片结果及相关纤维化指标也体现了Pg-Fe-hMSC的良好治疗作用(图4)。
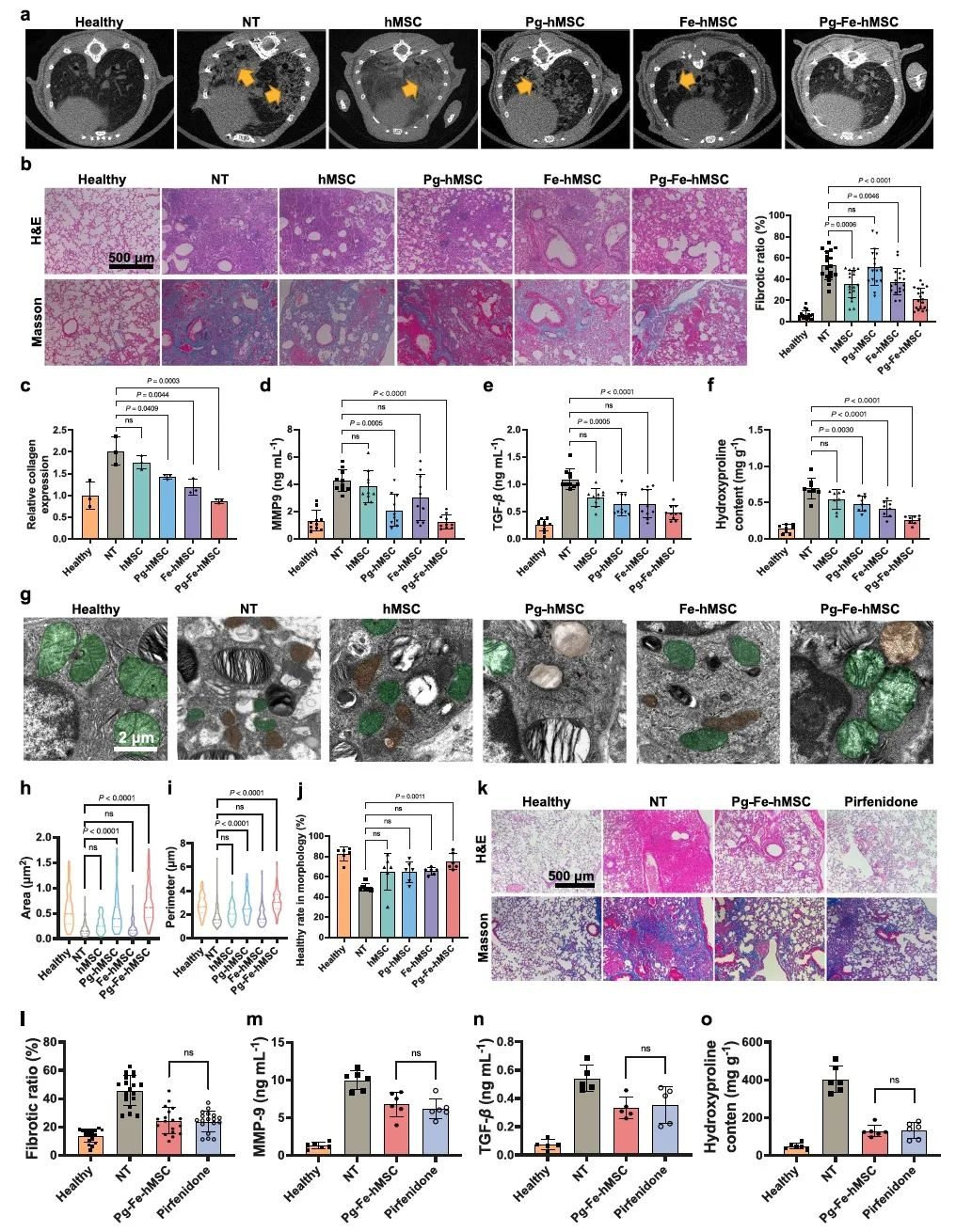
图4.Pg-Fe-hMSC实现对已经进展的小鼠肺纤维化的有效干预治疗。
考虑到小鼠肺组织与人肺组织的差异性,更好地模拟肺纤维化的疾病过程,研究者们进一步构建3D肺细胞球。随后,将不同hMSC加入3D肺细胞球当中,可发现Pg-Fe-hMSC在3D纤维化肺细胞球模型上表现出最佳的线粒体递送效率和保护作用。
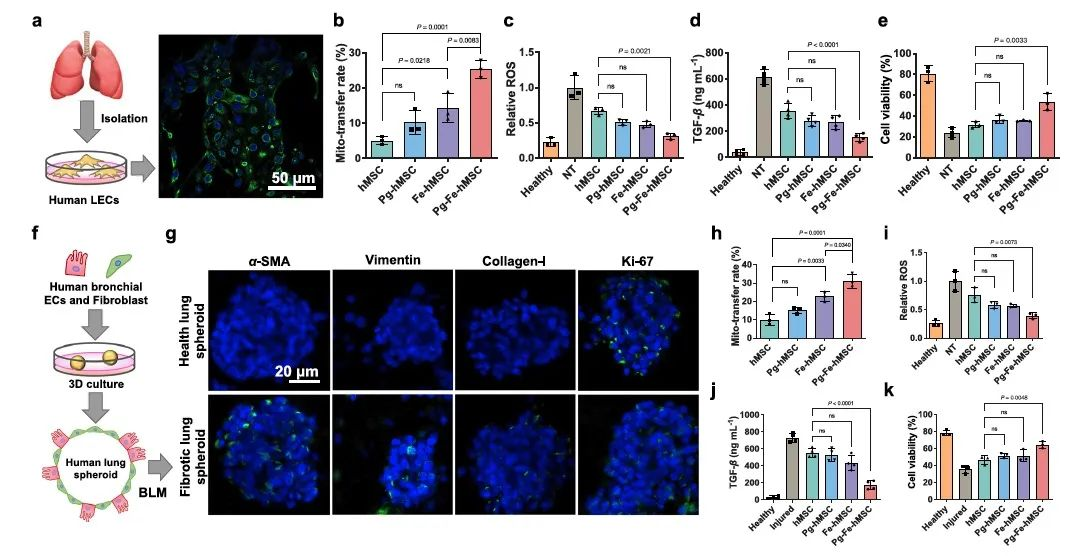
图5.Pg-Fe-hMSC实现对3D纤维化肺细胞球模型的有效干预治疗。
最后,通过RNA测序手段,研究者们从基因层面验证了,高效和持续的线粒体靶向递送可以有效恢复受损肺细胞的线粒体功能(图6)。
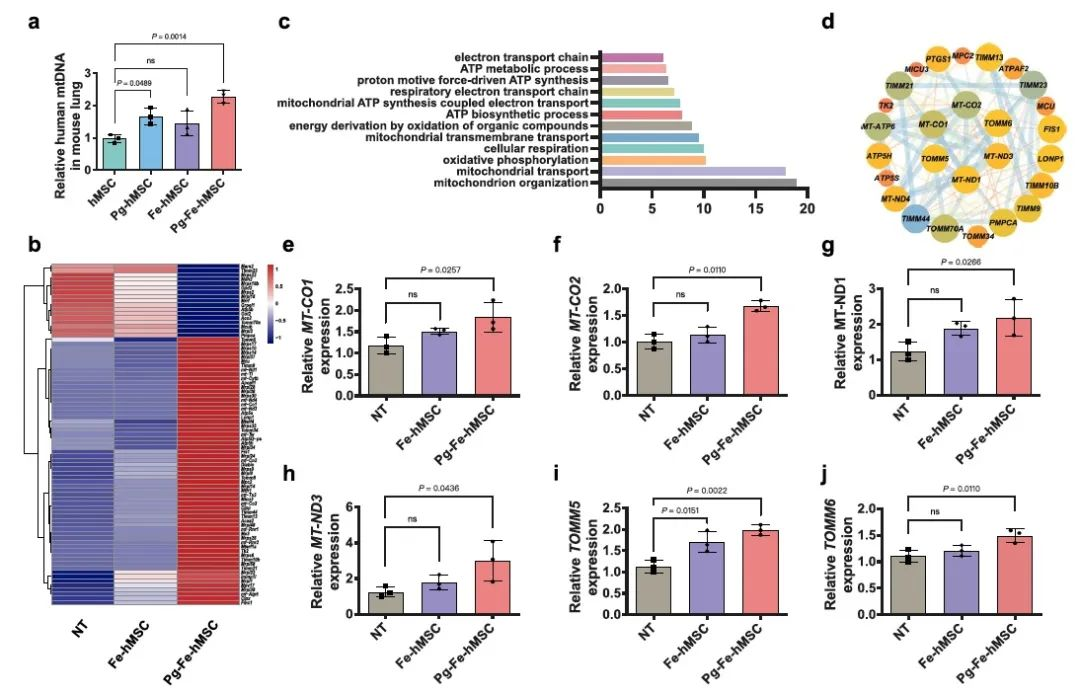
图6.RNA测序结果验证了Pg-Fe-hMSC可以有效恢复受损肺细胞的线粒体功能。
吉凯助力
本文GFP过表达慢病毒转染试剂盒由吉凯基因提供,助力高水平的科学研究。

公众号底部菜单栏【新功能】上线!
病毒实验帮
免费在线学习《国自然热点研究》、《数据库及软件操作教程》
一键下载《病毒使用手册》、《高分文献》
还有不定时的送新书、抽奖活动,赶紧来扫码关注一波吧
作者简介
浙江大学药学院的高建青教授和张添源特聘研究员为本文的通讯作者,博士研究生黄婷为本文的第一作者。高建青教授团队一直致力于基于干细胞及其衍生物的生物载体靶向递送系统的构建及用于重大疾病的治疗研究,近年来在Nature Communications, Science Advances, Advanced Materials, Advanced Functional Materials, ACS Nano, Journal of Controlled Release, Stem Cells Translational Medicine等期刊持续发表了系列研究成果,显示了干细胞及干细胞来源的外泌体在脊髓损伤、脑卒中、纤维化和肿瘤等疾病治疗中的良好应用前景,部分成果已推进至临床治疗研究。
