重组腺相关病毒(rAAV)以低免疫原、非整合、广泛组织靶向性而成为有前景的动物实验手段及基因治疗平台。目前,AAV广泛用于小鼠、猴子等模式生物的转基因研究以及临床试验,包含阿尔茨海默氏病、关节炎、脂蛋白脂肪酶(LPL)缺乏、帕金森氏病、肌肉营养不良和恶性肿瘤等众多疾病【1】。
但天然的rAAV基因组为单链DNA(ssDNA),必须依靠细胞复制因子来合成互补链,此步骤是rAAV载体表达效率及开始表达时间的限制因素【2】。
经过ITR改造,自互补AAV(scAAV,即双链AAV)绕过了第二链合成的限速步骤,除了提升载体递送效率之外,还可增加体内外转基因表达的强度、缩短开始表达时间,以及具有更高的体内DNA稳定性和更有效的环化作用,低剂量scAAV即可实现高剂量ssAAV的表达效果,可以有效降低动物实验的成本,尤其是以猪、猴子等大型动物为研究对象的实验【3】。
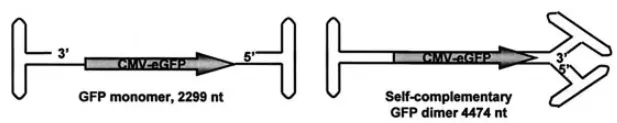
图1. ssAAV及scAAV结构图
在以下研究中,作者对比了单链ssAAV和双链scAAV在体内的表达情况。首先,构建了CMV驱动的促红细胞生成素基因(mEpo)ssAAV,以及对应的二聚体形式scAAV,分别注射2E+10病毒至小鼠门静脉,并以7天为间隔检测mEpo的表达,结果如图2所示:scAAV表达周期比ssAAV提前一周,且表达水平显著高于ssAAV【4】。
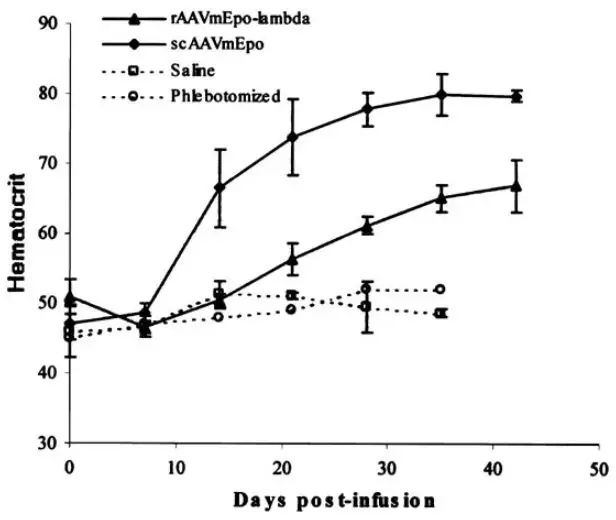
图2. mEpo表达示意图
基于以上研究成果,吉凯基因研发人员开发出了scAAV载体,利用CMV-Luc报告系统检测,结果表明无论在细胞水平还是在体水平scAAV的转导效率更高、表达时间更快。具体结果如下:
1. 细胞水平
以相同剂量梯度的ssAAV和scAAV感染293T细胞,于72小时检测荧光素酶活性,结果如图3所示:scAAV转导效率较常规ssAAV提升1.5-2倍。

图3. ssAAV和scAAV感染293T细胞效率对比
2. 动物水平
以ssAAV以及scAAV为载体将萤火虫荧光素酶报告系统递送至小鼠体内,通过尾静脉注射总量为1E+11的病毒并在多个时间点检测肝脏表达情况。结果如图5所示scAAV组荧光素酶表达显著快于ssAAV组,并且注射后相同时间点scAAV组荧光素酶表达水平显著高于ssAAV组。

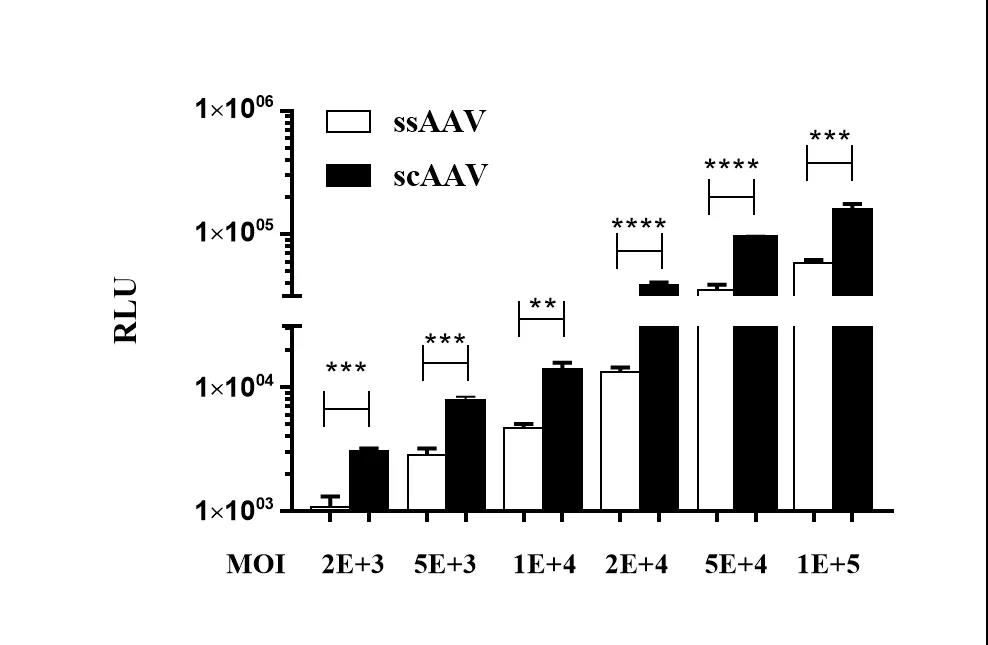
图4. scAAV及ssAAV 在小鼠体内不同时间点表达效果检测
在基因治疗研究领域,病毒转染效率低、病毒滴度有限等问题制约着基因治疗的发展。而scAAV则有望克服以往难题,推动基因治疗领域的发展【8、9】。目前已有相关研究表明scAAV用于基因治疗的可行性。小编以三篇文章为例简述:
一、青光眼的基因治疗
将单剂量的scAAV.GFP注射到大鼠和食蟹猴眼中。通过荧光,免疫组化和无创性淋巴镜检查来评估GFP的表达。直至注射后27天,在注射AAV的大鼠的前节组织上均未观察到GFP转导。相比之下,scAAV可以非常有效地转导小梁网,起效快(4天)。眼睛保持清澈,未观察到不良反应。如图5、6所示:转基因表达在大鼠中持续> 3.5个月,在猴子中持续> 2.35年【5】。
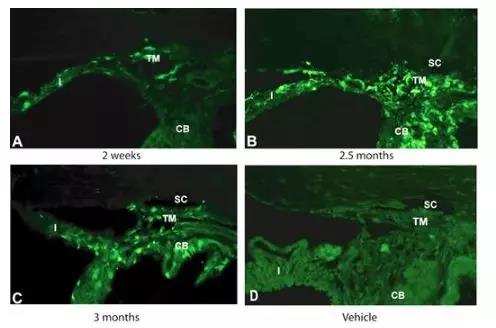
图5. 大鼠眼部注射scAAV2.GFP后不同时间点GFP表达检测

图6. 猴子眼部注射scAAV2.GFP后不同时间点GFP表达检测
在大鼠和猴子的小梁网中scAAV病毒载体提供更长时间且安全的转导,因此其可被开发为小梁网药物用于青光眼的基因治疗。
二、角膜移植
角膜内皮细胞(CEC)在角膜后表面形成一个单层,与视力密切相关。他们的泵功能是角膜基质消融以维持角膜透明所必须的。因为其是单层细胞所以每个细胞都与培养基直接接触。而且其没有血管和免疫能力,降低了免疫反应的风险。此外在移植前其在体外培养一到四周,因此给予了开发基因治疗的可能。然而使用ssAAV需要极高的病毒滴度以保证基因的表达,而scAAV的出现有望解决这一难题。
该研究表明,在大多数情况下,scAAV载体仅需要一半用量即可达到与ssAAV相等或更高的基因表达率。在人类供体角膜中,同样用量的scAAV可达到感染并在64.7±11.3%的细胞中表达GFP,而SSAAV仅可在38.0±8.6%的细胞中表达(p <0.001)。此外,scAAV转导的细胞可保持活力并显示规则的形态【6】。
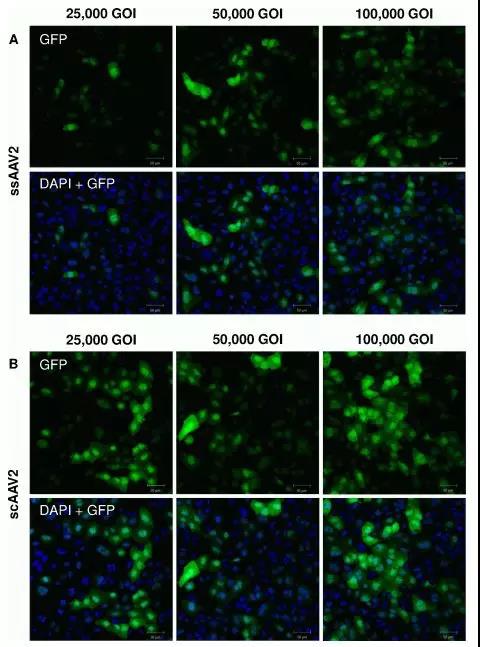
图7. 不同滴度的ssAAV2和scAAV2感染HCEC12细胞两天后效果检测
三、递送含有结构的基因
研究发现scAAV更适合递送shRNA等含有结构的基因。如图8所示,研究人员发现使用ssAAV载体构建shRNA会产生较多的截短和有缺陷的AAV基因组,从而降低产量。而scAAV由于不存在第二链的合成,不受序列结构影响,从而实现高效稳定地表达【7】。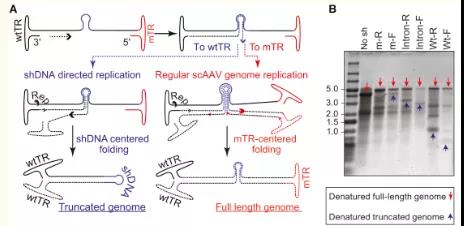
图8. ssAAV、scAAV基因组复制模型及短发夹DNA截断示意图
scAAV递送如shRNA这样含有结构的遗传物质,可以有效降低截断型无效aav基因组,提升了病毒基因组稳定性及表达效率,为基因治疗提供了可靠的递送方式。经过大量测试,除在极化的气道上皮细胞与慢性淋巴细胞性白血病(B-CLL)细胞中scAAV载体转导效率较之ssAAV未有明显改善外,在啮齿类动物、犬类和非人类灵长类动物模型中,均发现scAAV的转导效率较之ssAAV显著提高【8】。
综上,scAAV因其表达快、感染效率高、作用时间久且免疫原性低等特征,使得在使用ssAAV遇到问题时有了更有效的替代工具。尤其是在临床试验中,scAAV使得基因治疗前景更加光明。然而因为scAAV载体容量仅为ssAAV载体的一半,这一定程度上限制了scAAV的应用,不过我们相信随着技术的发展,科学家们终会开发出更加突破性的递送介质。
想要了解更多资讯,欢迎关注公众号【病毒实验帮】~为您实时更新前沿信息!
