溶瘤病毒(Oncolytic Virus)是一类基于多效作用模式的独特抗癌药物,除了病毒诱导的肿瘤细胞裂解之外,还可以激活体内肿瘤免疫反应。这些经过基因改造的多种溶瘤病毒产品已逐步进入临床试验阶段,个别产品已进入到临床III期。溶瘤病毒疗法在为试验不同的治疗方案提供机会的同时,也给产品的临床转化带来了挑战。本篇文章将分上下两个篇章,以六种在临床试验中使用的溶瘤病毒产品为例,描述了溶瘤病毒产品临床级别生产的要求和挑战。鉴于先前FDA对溶瘤病毒药物T-Vec的审批上市,进一步扩大溶瘤病毒的制造规模,优化产品特性的策略将会受到人们越来越多的关注。
2015年,美国FDA对来自Amgen的I型单纯疱疹病毒产品Imlygic(T-Vec)进行了批准上市,以用于黑色素瘤的治疗,成为第—个被业界广泛认可的溶瘤病毒药物,并作为在手术切除、化疗、放疗、靶向性小分子和抗体类药物治疗之外一类新的临床肿瘤学治疗手段。与传统临床肿瘤治疗方式不同的是,溶瘤病毒采用了其特有的作用机理进行针对肿瘤细胞的病毒感染、复制、细胞裂解和扩散传播。溶瘤病毒药物在近期的临床和临床前研究中表明了多效治疗活性,包括:1)溶瘤病毒引导的肿瘤细胞裂解在动物模型和临床患者体内中被证实可以触发全身性肿瘤免疫反应;2)治疗性目的基因的插入可以通过多种途径触发肿瘤细胞死亡;3)肿瘤组织血管内皮细胞对溶瘤病毒敏感,从而导致并间接摧毁肿瘤细胞。作为一种多功能的治疗方式,溶瘤病毒产品为异质性肿瘤的治疗,避免耐药性的发展,以及多种治疗手段的联合治疗的应用提供了希望和机会。
目前,除了以T-Vec为代表的单纯疱疹病毒之外,还有多种病毒产品也进入到了临床试验阶段,并展现出优秀的潜力。这些溶瘤病毒在病毒结构、大小、基因组、复制机制和宿主相互作用方面均存在差异和多样性,而这些多样性也更进一步为研究者们提供了对溶瘤病毒进行改造的机会。但是,与此同时,溶瘤病毒的多样性也为研究人员带来了临床转化的挑战,安全性问题以及GMP级生产需要针对每种病毒产品进行讨论分析。
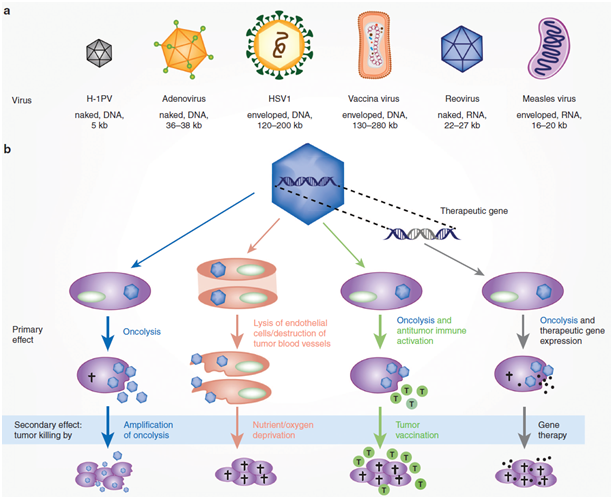
Fig 1. 多样化的溶瘤病毒及其作用机理
(Ungerechts, G. et al. Moving oncolytic viruses into the clinic: clinical-grade production, purification, and characterization of diverse oncolytic viruses. Molecular Therapy - Methods and Clinical Development 3, 16018 (2016))
基于良好的裂解活性和对其结构与复制周期的不断研究,腺病毒被视为一种有吸引力的溶瘤病毒候选者。腺病毒是一种无包膜的双链DNA病毒,具有中等基因组大小(~30-40kb),可感染的细胞范围广泛。其基因组在感染的过程中不会整合宿主细胞的染色体中,且病毒滴度高,较易于纯化和制备。目前已有多种溶瘤腺病毒已经进入到了临床试验阶段,其中CFDA在2005审批通过了溶瘤腺病毒安珂瑞(H101)上市,用于治疗以鼻咽癌为主的头颈部肿瘤。
与任何的新型肿瘤疗法一样,溶瘤腺病毒从实验室到临床试验阶段的转化过程,均受制于有关具体规定,并且必须满足关于选择性、药效、稳定性和产品表征的明确标准,应特别注意稳定的GMP工艺流程,包括主细胞库的建立、主毒株库的建立和建立严格稳定的质量放行标准。在溶瘤腺病毒的生产中,部分生产者会使用HEK293细胞,以获得较高的病毒滴度。但是,这些细胞具有腺病毒E1基因的插入位点,DNA的重组整合很可能导致E1基因对野生型的修饰被退回。此外,另一个挑战是对使用的主细胞库和主毒株库的持续监控,包括对细胞属性和污染物的监控。
疱疹病毒 (Herpes Virus)
单纯疱疹病毒(HSV)是一种有包膜的双链DNA病毒,具有较大基因组(~150kb),适合较大的基因片段插入。HSV结构复杂,在其包膜和衣壳之间被称为被膜(tegument)的区域,包含有20多种HSV蛋白,对HSV的传染性起到至关重要。其包膜表面有12个糖蛋白,衣壳也由7种不同的蛋白质组成。因此,HSV复杂的结构对生产制造提出了很多挑战。这些大尺寸(155 – 240 nm)的病毒,需要在纯化过程中保持结构的完整性,且对最终产品完整特性的衡量与描述也提出了挑战。152kb大小的基因组具有长区和短区的特有区域,每个区域都能侧接末端重复区域(重复区域为某些HSV基因多次存在,如ICP34.5),它们相对彼此存在4个可能的排列方向,而每一种排列方向都意味着一种异构体的存在。这些特征都使得对HSV基因组全面测定衡量更加复杂。
基于减毒疫苗株的溶瘤麻疹病毒处于现阶段的临床试验研究中,作为一种潜在的癌症治疗方式,诱导免疫介导的肿瘤排斥反应。溶瘤麻疹病毒是优先通过在恶性肿瘤细胞表面过表达的膜蛋白CD46进入肿瘤细胞。与使用麻疹病毒作为疫苗所不同的是,麻疹病毒的溶瘤活性取决于高浓度的感染性颗粒的存在,整个生产和纯化过程必须在温柔的GMP和无菌条件下进行。现阶段的批次制备尽管已经符合了临床要求,但纯度有进一步的提高空间。
当前,业界正在寻求多种策略来提高麻疹病毒制剂的总产量和纯度。使用微载体培养或是切换到悬浮培养有希望提高病毒滴度。另外,开发与麻疹病毒相容的色谱提纯技术,如离子交换色谱,可作为提高与颗粒无关的核酸和蛋白质杂志的去除率的一个选项,从而提高临床用溶瘤麻疹病毒的批次产量。
Reference:
2. Sheridan, C (2015). First oncolytic virus edges towards approval in surprise vote.
Nat Biotechnol 33: 569–570.
3. Russell, SJ, Peng, KW and Bell, JC (2012). Oncolytic virotherapy. Nat Biotechnol 30: 658–670.
4. Bell, J and McFadden, G (2014). Viruses for tumor therapy. Cell Host Microbe 15: 260–265.
5. Lichty, BD, Breitbach, CJ, Stojdl, DF and Bell, JC (2014). Going viral with cancerimmunotherapy. Nat Rev Cancer 14: 559–567.
6. Woller, N, Gürlevik, E, Ureche, CI, Schumacher, A and Kühnel, F (2014). Oncolytic virusesas anticancer vaccines. Front Oncol 4: 188.
7. Coffin, RS (2015). From virotherapy to oncolytic immunotherapy: where are we now?
CurrOpinVirol 13: 93–100.
8. Bauzon, M and Hermiston, T (2014). Armed therapeutic viruses - a disruptive therapy onthe horizon of cancer immunotherapy. Front Immunol 5: 74.
9. Larson, C, Oronsky, B, Scicinski, J, Fanger, GR, Stirn, M, Oronsky, A et al. (2015). Going viral:a review of replication-selective oncolytic adenoviruses. Oncotarget 6: 19976–19989.
10. Wisher, M (2002). Biosafety and product release testing issues relevant to replicationcompetentoncolytic viruses. Cancer Gene Ther 9: 1056–1061.
11. Lusky, M (2005). Good manufacturing practice production of adenoviral vectors for
clinical trials. Hum Gene Ther 16: 281–291.
12. Working, PK, Lin, A and Borellini, F (2005). Meeting product development challenges inmanufacturing clinical grade oncolytic adenoviruses. Oncogene 24: 7792–7801.
13. Kovesdi, I and Hedley, SJ (2010). Adenoviral producer cells. Viruses 2: 1681–1703.
14. Nadeau, I and Kamen, A (2003). Production of adenovirus vector for gene therapy.
Biotechnol Adv 20: 475–489.
15. Roizman, B (1979). The structure and isomerization of herpes simplex virus genomes. Cell16: 481–494.
16. Liu, BL, Robinson, M, Han, ZQ, Branston, RH, English, C, Reay, P et al. (2003). ICP34.5
deleted herpes simplex virus with enhanced oncolytic, immune stimulating, and antitumourproperties. Gene Ther 10: 292–303.
17. Dörig, RE, Marcil, A, Chopra, A and Richardson, CD (1993). The human CD46 molecule is areceptor for measles virus (Edmonston strain). Cell 75: 295–305.
18. Anderson, BD, Nakamura, T, Russell, SJ and Peng, KW (2004). High CD46 receptor densitydetermines preferential killing of tumor cells by oncolytic measles virus. Cancer Res 64:4919–4926.
19. Langfield, KK, Walker, HJ, Gregory, LC and Federspiel, MJ (2011). Manufacture of measlesviruses. Methods Mol Biol 737: 345–366.

